はじめに
岩手医科大学整形外科学講座 教授 嶋村正先生
「痛み」は、人間にとって深刻で複雑な問題である。痛みの感じ方は人それぞれであり、個人的かつ主観的な感覚であるため、周りの人達が的確に理解することは難しい。その結果、患者さんのQOLを低下させ、社会生活を困難にすることもある。特に、慢性難治性疼痛では、治療に難渋する場合も少なくない。一方、近年の痛みに関する様々な受容体の発見や疼痛メカニズムの解明により、慢性難治性疼痛に対する薬物治療も飛躍的に発展している。そこで、本セミナーでは、東京大学大学院医学系研究科生体管理医学講座麻酔学教授の花岡一雄先生をお招きして、痛みの基礎と臨床における最新の知見をお話しいただき、急性疼痛から慢性難治性疼痛までの対処法を伝授していただくことにする。
講演
東京大学大学院医学系研究科 生体管理医学講座麻酔学教授 花岡一雄先生
「痛み」の背景と基本姿勢
痛みは、病の兆候で最も多く、医学・医療の原点である。米国では、2001年から2010年までを「痛みの10年(the
Decade of Pain Control and Research)」とし、研究・治療に対する杜会の対応レベルの低さ、社会経済的な損失を改善するために、痛みの評価を診療の義務としている。
近年、わが国でも疼痛患者数が著しく増加し、国民総生産にも大いに関係する重要な問題となっている。ここ10年、痛みの研究においては、基礎・臨床の両面から著しい進歩が遂げられているが、単に、痛みを感覚的に解釈するだけでなく、個々の患者における疼痛メカニズムを明らかにし、それぞれに効果を有する薬物を使用することが求められている。
痛みの伝わり方
どうして痛みを感じるのか。生体では通常感覚として、冷覚、温覚、触覚、圧覚の4つがあり、皮膚や粘膜にはそれぞれに対応する受容器が分布している。痛み刺激の受容器は侵害受容器と呼ばれ、自由神経終末である。生理的には、機械的刺激に反応す「Mechanonociceptor」、温度刺激に反応する「Thermonociceptor」、化学的刺激や機械的刺激など様々な刺激に反応する「Polymodalnociceptor」がある。
生体に侵害刺激を加えると、体表での変形、次に自由神経終末の歪み、細胞膜レベルでの歪みが生じ、細胞膜の電気的特性が変化して活動電位が生じ、インパルスが発生する。このインパルスを上位中枢に伝導する脊髄神経には、有髄のAδ線維と無髄のC線維がある。Aδ線維により伝達されるのは瞬間的な速く鋭い痛みであり、C線維によって伝えられるのは少し遅れて生じる鈍い痛みである。つまり、痛みにはQuick
Pain(一次痛)とSlow Pain(二次痛)の2つがあり、総称して「Dual
Pain」と呼ばれている。
侵害受容器から、末梢神経である一次ニューロンを伝わり脊髄に送られたインパルスは、脊髄灰白質の二次ニューロンに中継される。二次ニューロンは2~3分節上で反対側へ交差し、脊髄前側索を上行して上位中枢に向かう。この上行路は、鈍い痛みを伝える「古脊髄視床路」と鋭い痛みを伝える「新脊髄視床路」に分かれる。古脊髄視床路は、一部、大脳辺縁系を経由して大脳皮質に至るため、自律神経や情動による影響を受けやすい。最終的に痛みの信号が伝達されるのは大脳皮質であるが、その詳細な部位については次第に明らかにされている。
痛みと生体反応
●痛みの調節機構
痛みと侵害刺激の強さが必ずしも相関しないことから、生体における痛みの調節機構の存在が推察されている。
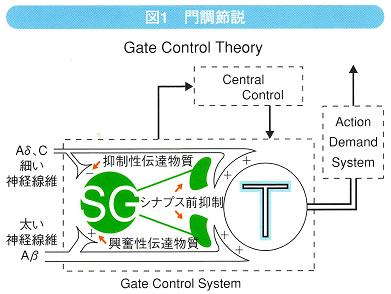
脊髄レベルでの調節機構については、Melzackらが「門調節説(Gate
Control Theory)」を捉唱した(図1)。これは、触覚、圧覚受容器であるAβ線維からのインパルスが入力されると抑制性介在ニューロン(SG)が興奮し、ゲートが即座に遮断され、脊髄後角のtransmission
cell(T)へAδ線維、およびC線維を介した痛み刺激が伝達されなくなるというものである。この説は「皮膚をさすると痛みが軽減する」という、誰もが経験する現象をよく説明している。
また、生体には痛みの自動調節機構が存在している。生体防御には不必要な強度の痛みを制御する機構で、ノルアドレナリンやセロ.トニンといった神経伝達物質が刺激伝達を抑制する。中脳水道周囲灰自質、網様体核などから脊髄へと下行性に分布するため下行性痛覚抑制機構と呼ばれている。
生体は、最終的にインパルスを第二次体性感覚野で受信し、弁別性ニューロンがインパルスの波形により侵害性刺激か否かを判別する。音楽、慰め、励ましなどが痛みを軽減するのは、伝達過程で大脳辺縁系などを介しインパルスの波形を痛みと捉えられないものに変調させる情動因子として働くからである。
●痛みの悪循環
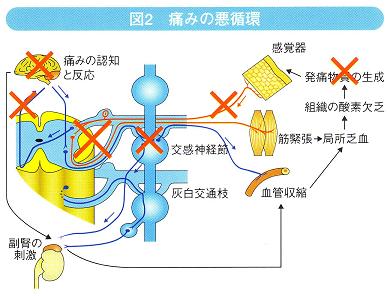
痛みが生体にとって問題となるのは、不十分なコントロール下で「痛みの悪循環」が生じる点である。
外因性の痛み刺激が入力されると、脊髄反射により筋緊張が起こる。上位中枢が痛みを認知すると、副腎からアドレナリンが分泌され、交感神経節が刺激されて血管が収縮する。筋緊張と血管収縮により局所乏血が起こると組織の酸素が欠乏し、細胞が崩壊して様々な発痛物質が生成される。発痛物質には、ブラジキニン(BK)、セロトニン、ヒスタミン、アセチルコリン、カリウム、プロスタグランジン(PG)などがあり、疼痛・炎症にはこれらが多様に関与している。発痛物質はそれ自体が侵害刺激として感知されるため、これらが生成される限り、外部刺激がなくても痛みが起こるという悪循環に陥る。したがって、この悪循環を断つためには、発痛物質の
生成を抑制する、交感神経ブロックや硬膜外ブロックなどでインパルスの入力を抑制する、上位中枢へのルートを切断する、痛みの認知を抑制するといったことが必要となる(図2)。
痛みの分類と治療
痛みは、原因によってNociceptive(侵害受容性の痛み)、Neuropathic(神経因性疾痛など)、Psychogenic(心因性疼痛など)に分類される。これらの痛みは時間の経過とともに独立していたものが徐々に融合し、分離が困難な慢性の難治性疼痛となる。
また、急性疼痛と慢性疼痛という分類もされる。急性疼痛は、組織傷害に伴う痛みでその持続期間は限られるが、慢性疼痛は組織傷害の治癒後にも続き、はっきりとした器質的原因を有さないことが多い。慢性疼痛における急性増悪期の痛みは急性疼痛と類似しており、内因性発痛物質であるBKが深く関与するとされている。抜歯後の疼痛をみた実験では、BK生成と疼痛強度の変化の柏関が明らかであった1)。
今日の疼痛治療薬の主流はNSAIDsである。その主作用は、PG合成酵素の一つであるシクロオキシゲナーゼ(COX)の活性阻害によるPG産生抑制であるが、COXにはCOX-1,COX-2といったサブタイプが存在しており、NSAIDs個々でサブタイプ間の阻害バランスが異なる。一般に、COX-1阻害作用が強いほど副作用としての消化管傷害が強く、COX2阻害作用が強いほど抗炎症作用が強くなると言われている(図3)。
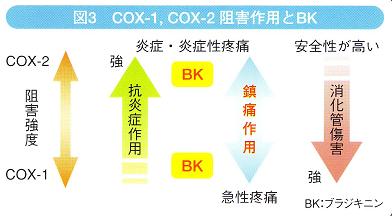
一方、PG白体には直接的な発痛作用はほとんどない。PGは他の発痛物質を介して疼痛を増強する調節物質であり、したがって、PG産生抑制を主たる作用とする多くのNSAIDsは、間接的な疼痛抑制作用しか持たないとも言える。主なNSAIDsについて、それぞれの主作用をまとめたのが表1である。純粋なCOX2阻害薬であるセレコキシブやiコフェコキシブなどは国内開発申であり、現在は使われていない。COX.2優位で、唯一抗BK作用を有しているのが、ザルトプロフェンである。ザルトプロフェンは、炎症部位のCOX-2を選択的に阻害するため、消化管傷害などの副作用が少なく、BKによって誘発される痛みも抑制する新しいタイブのNSAIDsである。高齢者、腎機能低下患者、関節リウマチ患者などでは、速効性で副作用が少ないザルトプロフェンが使い易い。

慢性難治性疼痛の診療に際して
●ドラッグチャレンジテスト(DCT)とは
慢性・難治性疼痛では、個々の患者の疼痛メカニズムが異なることから、受容体レベルで効果的な治療を行うために、どの薬物を組み合わせるかが重要となる。
そのため、当施設ではDCTを行っている。DCTは、鎮痛作用を有する薬物を少量ずつ静注し、疼痛の消長を観察することによりその機序を推察し、適切な治療法を選択するために行う検査法である。麻酔薬に類似した薬物を用いるため、モニター類、蘇生用具を準備して、酸素吸入下で行う必要がある。
痛みの評価には、visual analogue scale(VAS)を用いる。0を痛みがない状態、100を想像しうる最も強い痛みとし、患者に現在の痛みの強さを判定させる。小児や高齢者などVASの理解が難しい場合は、評価のスケールが笑顔から泣き顔までの顔つきになったフェーススケールを用いる。プラセボを2回投与してから実薬を投与し、VASにて判定する。
用いる薬物とその投与法は、以下の通りである。
①フェントラミンテスト
フェントラミン5mgを3回投与する。有効の場合は交感神経作動性の痛みを示し、治療には、神経ブロックや交感神経阻害薬、「グアネチジン又はレセルピン療法」が効果的である。
②バルビツレートテスト
チアミラール(またはラボナール)50mgを3回投与する。治療には、電気刺激やフェノバルビタール、ペントバルビタールの投与を行う。
③モルヒネテスト
モルヒネ3mgを最高5回まで投与できるが、VASが0になった時点で投与を中止する。有効の場合は侵害性疼痛を示し、治療にはモルヒネ、コデイン、ブブレノルフィンの投与、知覚神経ブロックなどを行う。
④リドカインテスト
リドカイン1mg/kgをボーラス投与し、その後、リドカイン1mg/kgを静注で30分間投与する。有効の場合は神経因性疼痛を示し、治療にはメキシレチン、抗痙撃薬、リドカイン療法、リドカインパッチなどを用いる。
⑤ケタミンテスト
ケタミン5mgを最高3回まで静注する。ケタミンはNMDA受容体拮抗薬であり、アロディニアに効果がある。アロディニアとは、触れる、なでるなどの刺激でも強い痛みを感じることである。治療には、ケタミンカプセルの舌下、ケタミンの静注、または代替としてデキストロメトルファンの投与を行う。入院患者には、ケタミン持続点滴療法を行う。まず、ペントバルビタール、ミダゾラム、ドロペリドール、ケタミンなどを単回投与し、ケタミンによる悪夢の発生を抑えるために、ケタミンと他の麻酔薬であるドロペリドールを併用し、2時間持続投与する。その間、呼吸抑制を防ぐために酸素を投与し、最後に覚醒を確認する。
⑥ベンゾジアゼピンテスト
ミダゾラム3mgを3回投与する。治療には、ジアゼパムまたはミダゾラムを投与するが、静注にはミダゾラムを使用する。投与方法は、ケタミン持続点滴療法と同様である。
⑦アデノシンテスト
量近、痛みに関与するアデノシン(ATP)受容体が発見された。ATPはA1受容体に作用して、シナプス後性興奮伝達を阻害することにより効果を発揮するが、神経終末からのサブスタンスPとカルシトニン遺伝子関連ペブチドの放出を阻害して、シナプス前性興奮伝達を阻害する作用もある。方法は、80μg/kg/分を3~4時間投与する。
⑧PGE1テスト
PGE1(60μg)を生理食塩水100mLと8.4%NaHCO。(5mL)に溶解し、0.02μg/kg/分で1時間投与する。PGE1では、末梢循環改善による鎮痛効果が認められ、治療には、リマプロストアルファデクス6錠/日を投与する。
●慢性疼痛に対する臨床試験成績
慢性疼痛における薬物の効果として、薬理学的疼痛機序判別試験の結果を紹介する。対象は、末梢神経損傷に続発した慢性疼痛に対して、DCTを施行した37症例(平均年齢55歳)。疼痛の内訳は、帯状疱疹後神経痛、腕神経叢引抜損傷、四肢の手術、外傷後の慢性痛、カウザルギーである。
テスト薬は、モルヒネ、ケタミン、リドカイン、チオペンタール、フェントラミン、ATPである。効果判定にはVASを用いた。
結果は、ケタミンが最も有効でモルヒネも効果が高かった(図4)。疾患別では、帯状庖疹後神経痛にはケタミン、モルヒネが、腕神経叢引抜損傷にはケタミンが、手術・外傷後の慢性痛にはケタミン、リドカインが非常に有効であった(図5)。
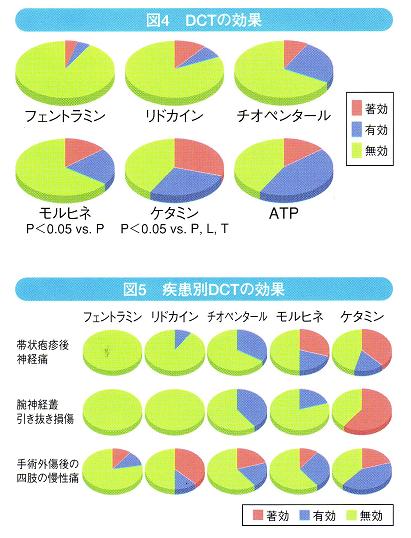
表2、表3にDCTの結果による疼痛機序とテスト薬有効例における後続の治療をまとめた。慢性・難治性疼痛の治療では、患者における疼痛の発生機序を鑑別し、それに見合った治療を選択することが重要であり、DCTは、その診断および治療に対し、非常に便利で有益なものであると考えられる2)。

結語
今後、急性疼痛、慢性・難治性疼痛に対する疼痛マネジメントは、患者QOL重視の観点から臨床的に重要な分野になると思われる。近年、疼痛治療に用いるNSAIDsとして、ザルトブロフェンのようなBK阻害薬が出現したことにより、疼痛に対する薬物療法も新しい時代に入ったと言える。慢性疼痛患者の増加が予想される今日、疼痛を専門とする臨床医がその治療に大きな役割を担うことは間違いないであろう。
【参考文献】
1)Swift,J.Q.et al.,J.Oral.Maxillofac.Sug. ,51,112-116.1993
2)林田眞和他.
末梢性神経因性疼痛における薬理学的疼痛機序判別試験(DCT)の結果とその臨床的意義:オピオイド研究の進歩と展望.ネオメディカル社,2004
(加茂)
http://junk2004.exblog.jp/d2004-11-26