はじめに
痛みは生体の防御にとって最も重要な役割を果たしているが,また同時に,その役割の範囲を超え,神経因性疼痛で代表される生体にとって不必要で侵襲的な激しい痛みをもたらすことがよく知られている。この神経因性疼痛は,末梢や中枢神経を含む組織の損傷後,傷が完全に治癒したにも拘わらず激しい痛みが持続するもので,多くのケースではモルヒネを含む多くの治療に抵抗性を示す。最近の報告では,癌性疼痛を訴える患者の40〜70%が,この神経因性疼痛の状態にある
とされており,多くの臨床医がその治療に苦慮している。この神経因性疼痛がどの部位で,どの様な機序で発現するのか長い間不明であったが,最近の神経科学の目覚ましい発展によって,その発生機序の一部がモデル動物を用いた実験によって明らかにされつつある。そこで,本稿では,神経因性疼痛のうち,最近明らかになってきた脊髄後角における発現機序について,私たちが得た生理学的な知見を加えて概説したい。
痛みの分類
はじめに述べたように,痛みには不可欠なものと不要なものとがある。そこで痛みを分類すると,1)侵害性疼痛ー生体に何らかの侵襲が加わったことを知らせ,防御機構を発現させるのに重要な役割を持つ。これが本来痛みが持つ役割と考えられる。2)癌性疼痛ーこの痛みは侵害性疼痛に加えることもあるが,ここでは以下に述べる理由により別に分類した。この痛みの発生は,侵害受容器への刺激に加えて,癌による神経圧迫や浸潤,臓器の機能障害や治療に伴うもの,その他多くの原因によって発生する。そして,前述したように,癌性疼痛の40〜70%が次に述べる神経因性疼痛に移行しているとの報告が多い。癌患者の中には,モルヒネを含むあらゆる治療にも十分な鎮痛が得られない例が報告されており,その痛みの発生基盤には何らかの神経損傷が関与しているものと思われる。3)神経因性疼痛ーこれは,末梢および中枢神経の損傷を基盤とし,受傷からある時間をおいて発生してくる激しい痛みである。これには,軽微な痛み刺激でも激しい痛みとして感じる痛覚過敏(hyperalgesia),不快な異常感覚を伴う自発痛(dysesthesia),本来痛みを発生しない軽い触刺激でも痛みを引き起こすアロディニア(allodynia)や切断した四肢に痛みを訴える幻肢
痛(phantom limb pain)などの異常痛がある。4)心因性疼痛ー心理的要因によって引き起こされる痛みで,仮面うつ病や神経症などでみられる。これらの痛みのうち,神経因性疼痛は,その痛みの激しさの故,また,あらゆる治療によっても十分な鎮痛が得られないため,患者は常に痛みの発作に怯え,病院を転々とする事が多いなどQOLの観点から,また,医療経済の観点からも早急にその原因を明らかにし,治療法を確立することが急務である。
神経因性疼痛の発生機序
神経因性疾痛の発生には,末梢神経の感受性増大や自発発火増大の持続など末梢神経に起因するものと,脊髄や上位中枢の変化に起因するものとがある。ここでは,末梢神経に起因するものは他の優れた総説にゆずり,主に脊髄後角で起こる可塑的変化について述べてみたい。脊髄感覚回路網の可塑的変化には,一つの細胞から次の細胞に情報伝達が行われるシナプス部位での伝達効率の変化(長期増強と長期抑圧がある)や関与する受容体の量および質の変化と回路網そのものが変化するものがある。長期増強や長期抑圧は記憶・学習など高次機能の中枢神経モデルとして大脳辺縁系の海馬や小脳で詳細に研究されている。脊髄後角でも,最近,同様の長期増強と長期抑圧が起こることが報告された。しかしそれが痛覚異常とどの様な関連を持つ
のかは不明である。一方,末梢神経の損傷によって脊髄内神経回路網の可塑的変化が起こることは以前から推測されていたが,1992年Woolfらは末梢神経損傷によって脊髄内感覚線維の軸索発芽が起こることを明らかにした1)。それは,ラットの坐骨神経を切断後6,9週に後角内で起こった感覚回路の可塑的変化を調べたものである。彼らは,触覚を伝える太い有髄のAβ線維に色素を注入し,脊髄後角内での終末分布を調べ,正常ラットのそれとは異なることを明らかにした。こ
れらの可塑的変化が感覚系の機能異常とどの様に関連しているか述べる前に,脊髄後角における感覚系の入力・出力回路網について概略を説明しておきたい。
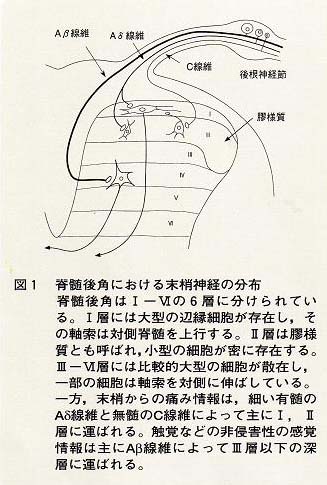
図1で示すように,脊髄後角はⅠ〜Ⅵ層に分けられている。これは,細胞の大きさ,密度およびその形による解剖学的な分類であった2)が,それらの層に存在する細胞の機能ともよく一致することから,後角の機能的分類としてよく用いられるものである。I層には辺縁細胞と呼ばれる大型の細胞が存在し,主に痛み情報を受けている(痛み特異性ニューロン)。そして,その痛み情報を反対側の視床を介し大脳皮質に伝えている。Ⅱ層は,小型の細胞が密に存在するためその組織学的特徴から膠様質と呼ばれている。ここの細胞は,侵害性と非侵害性の感覚情報を受けている。また,上位中枢からの下行性痛覚抑制系の主な終末部位であること,種々の痛覚関連ペプチドが多く存在すること,この部位へのモルヒネの投与によって深層に存在する投射ニューロンの侵害刺激応答のみが選択的に抑制を受けることなどが報告されており,痛みの伝達とその修飾に重要な役割を果たしていると考えられる部位である3)。Ⅲ層からⅥ層の深部には,比較的大型の細胞
が存在し,特にⅣ/Ⅴ層には視床への投射ニューロンが存在する。このニューロンはⅠ層の投射ニューロンと異なり,機械,熱および化学的侵害性と非侵害性の感覚情報を受容しており,広作動域(wide
dynamic range ;WDR)ニューロンと呼ばれる。一方,末梢からの感覚入力をみてみると,速い痛み(例えば肘をテーブルの角にぶつけた時の最初の痛み)は有髄の細いAδ線維によって運ばれ,主にⅠ,Ⅱ層に終末し,一部はⅤ層に終末する。速い痛みに続いて起こる持続性の遅い痛みは無髄のC線維によってⅠ,Ⅱ層に伝えられる。一方,触覚など非侵害性の感覚情報は,Aβ線維によってⅢ層以下の深層に伝えられる。このような層特異性の入出力様式は脊髄のみでなく,大脳皮質においても同様にみられる。さらに,大脳皮質も後角と同様6層からなることを考えれば,その基本的な情報処理機構には類似性があるのではないかと思われる。
脊髄後角細胞に誘起される長期増強と長期抑圧
長期増強(long term potentiation;LTP)は,BlissとLomoによって1973年,海馬において初めて見いだされた4)。この現象はその持続が非常に長いこと,また,海馬が記憶と密接に関与していることから,記憶・学習の細胞レベルでの変化を説明出来るものと考えられ,多くの分野の研究者が精力的に研究を進めている。しかし,脊髄では,長くLTPの報告はなかった。1993年Randicらのグループは幼若ラットの脊髄スライス標本を用い,後根刺激によってLTPが誘起されることを報告している5)。このLTPは,後根刺激によって後角細胞に誘起される興奮性後シナプス電位(excitatory
post synaptic potential;EPSP,膜電位固定法では,excitatory post
synaptic current;EPSC)が,後
根を高頻度で頻回刺激した後にはその振幅が増大する現象を言う(図2)。そして,その振幅の増大は少なくとも数時間以上持続する。この振幅の増大には細胞内のカルシウム濃度の増加が重要な役割を果たしている。
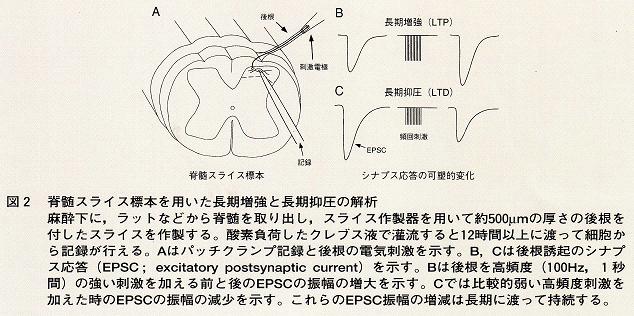
長期抑圧(long term depression;LTD)は頻回刺激によってEPSPの振幅が長期に渡って減少するものである。これは,小脳のプルキンエ細胞で初めて見いだされた6)。その後,他の中枢神経細胞でも報告されている。この長期に渡るシナプス伝達の抑制もRandicらのグループによって幼若ラットで報告されている5)。このLTDにも細胞内カルシウム濃度の増大が関与しているが,その濃度の変化が少ない時にはLTDに,ある濃度以上ではLTPが誘起されると考えられている。LTPはその現象から,痛覚過敏などの病的状態の発生基盤である可能性があるが,行動学的変化との関連は明らかにはされていない。また,LTDは感覚情報が長期に渡って抑制される現象であるが,そ
れがどの様な症状と関連するか不明である。これらの長期に渡る感覚系の可塑的変化は,いずれも幼若動物において報告されたもので,成熟動物でも同様な変化が誘起されるか否かは未だ明らかではない。筆者の研究室でも成熟ラットの膠様質細胞から記録を行い,同様の頻回刺激を加えシナプス伝達の可塑的変化を観察したが,明らかなLTPやLTDは観察されなかった。今後,このような可塑的変化が,脊髄感覚系の発達とどの様な相関があるのか,また,行動学的異常とどの
様に関連するかを明らかにしていく必要がある。
末梢神経切断後にみられる感覚回路網の変化
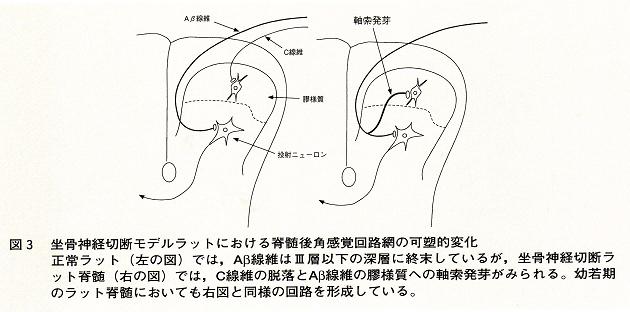
つぎに,Woolt, ShorlandとCoggeshallらが見いだした感覚回路網の可塑的変化について述べる。彼らは坐骨神経切断ラットを用い,本来ⅡーⅢ層の境界より深層に終末していたAβ線維の一部が軸索発芽を起こし,その境界を越えてⅡ層,あるいはⅠ層にまでその枝を伸ばしていることを明らかにした(図3)。このAβ線維の軸索発芽はどの様な機能異常と関連しているのであろうか。前述した様に,Ⅱ層の膠様質細胞は多くの痛覚線維入力を受けていること,また,膠様質へのモルヒネの投与は痛み応答を選択的に抑制すること,さらに,そのほとんどが痛み刺激で興奮を示すこと,痛覚関連神経伝達物質を多く含むことなどから,膠様質へ入力した情報は痛みを引き起こすと考えられる。それ故,触覚などを伝えるAβ線維が膠様質にその情報を伝えることは,触刺激でも痛みを引き起こす,いわゆるアロディニアの発生機序の一つと考えられる。筆者の教室でも生理学的にAβ線維刺激によって膠様質細胞にどの様なシナプス応答が誘起されるかを検討したが,おおむね解剖学的結果を支持するものであった。しかし,直接入カしているAβ線維の数は,坐骨神経を切断してからの時期によって異なる。例えば,切断後2週では,Aβ線維はまだ膠様質へは到達しておらず,介在ニューロンを介してその情報が伝えられていた。Aβ線維からの膠様質細胞への直接入力は時間をおくに従って増加し,Aβ線維の軸索発芽には一定の時間がかかるものと思われた。行動学的には坐骨神経切断ラットでは,同側後肢の爪や指を噛む,いわゆる自傷行動がみられるが,その自傷行動発現の時間経過とAβ線維シナプス入力との間には時間的なズレがみられ,その行動変化がアロディニアとどの様に関連しているかは今のところ不明である。
それでは,このような軸索発芽を伴う感覚回路網の可塑的変化がどの様にして発現してくるのであろうか。坐骨神経切断によって起こる末梢神経の主な変化は,脊髄内でのC線維の変性脱落である。有髄の線維はその口径が大きいためか明らかな変性は認められない。さらに,C線維の変性脱落は,神経栄養因子の一つであるnerve
growth factor(NGF)をあらかじめ脊髄腔内に投与しておくと阻止されること,また,その結果Aβ線維の軸索発芽も起こらなくなること7)から,Aβ線維の発芽には,C線維の変性脱落が引き金になっていると思われる。それによって未知の物質が膠様質に分泌され,それがAβ線維を膠様質に誘導しているものと思われる。脊髄の発生初期にはそれと類似の物質が分泌され,脊髄内での軸索誘導が起き,回路網が完成されることが明らかになってきた。そのような物質の一つとして最近,分子生物学的手法を用いてネトリン(netrin)が同定された8)。神経系発生初期に神経管が形成されるが,その腹側部に存在する床板(floor
plate)からこのネトリンが分泌される。そして,その濃度勾配に従って後角に存在する投射ニューロンが軸索を腹側に伸ばし,最終的には反対側に移行し,視床など上位中枢に情報を伝えるようになる。今後,研究が進むにつれて感覚回路の可塑的変化を引き起こす誘導物質が発見されるであろう。そうなれば,その作用を抑制することも可能となり,神経因性疼痛の治療法の開発も進むものと期待される。また,C線維の変性脱落を抑制することも,可塑的変化を阻止することにつながるものと考えられる。
ここで,坐骨神経切断後に起こる感覚回路網が,幼若期のそれとどの様な関連があるのか少し考察したい。これは,神経伝達物質と結合する受容体が,末梢神経損傷によって,幼若期のそれと置き換わることが知られているからである9)。この変化は多くの場合,その受容体を構成しているサブユニットの組み替えが起こることによっている。即ち,成熟するに従ってサブユニットの組み合わせが幼若型から成熟型に置き換わってくる。しかし,神経損傷が起こると再び幼若期のそれに変わってしまう。受容体レベルで起こるそのような可塑的変化が,神経回路網においても起こって
いることを支持する報告がある。それは,幼若期と成熟期ラット脊髄でのAβ線維とC線維の終末分布をみたものである10)
11)。それによると,幼若期では,C線維が細いため発達が遅れ,膠様質にはC線維からの入力は少ない。その代わりにAβ線維からの入力が多い。成長に伴い,C線維が膠様質に痛み情報を伝える様になるため,Aβ線維は必要なくなり,Ⅲ層以下の深層に後退する。この幼若期にみられる感覚回路網は,末梢神経損傷時にみられる回路網に類似している(図
3)。これらの観察から,いったん感覚回路網が完成した後にも,末梢神経の損傷が起これば,神経系はダイナミックに反応し,環境変化に対応しているのではないかと考えられる。即ち,ここでみられた可塑的な変化は,感覚回路網の代償機構であると考えることも出来る。もしそうであるなら,神経因性疼痛は過剰な,または不十分な代償の結果起こっているのかもしれない。
慢性炎症性モデルラットにおける感覚回路の変化
つぎに慢性炎症ラットにみられる感覚回路網の変化について今まで得られた知見を述べたい。慢性炎症では,その部位に痛覚過敏が起こることが知られているが,モデルラットでも同様なことが起こるのであろうか。例えばラットの足底に炎症物質を投与して行動の変化を調べてみると,ほぼ100%のラットで痛覚過敏が認められる。この痛覚過敏の発生機序は何であろうか。電気生理学的な手法を用いて調べてみると,坐骨神経切断モデルラットと同様,Aβ線維がその情報を膠様質細胞に伝える様になることが明らかになった2)。坐骨神経切断モデルと異なるとこは,Aβ,Aδ
線維とC線維応答の大きさが異なる点である。前述したように,坐骨神経切断ラットでは,C線維の変性脱落が起こりC線維応答は著明に減少するが,炎症モデルラットではC線維応答がAβ,Aδ線維応答に比較して増大する。即ち,正常ラットでは,A線維入力は,C線維入力より大きい傾向があったが,炎症ラットでは,C線維応答がA線維応答より有意に大きくなる。C線維が痛みと密接な関連を持つことからこの変化は痛覚過敏を反映している可能性がある。この慢性炎症モデルラットでは,坐骨神経切断モデルラットと異なり,末梢からの持続的な感覚入力の増大がみられる。
そのため,このような可塑的変化が起こったものと思われるが,現在までのところ慢性炎症に伴うこれらの変化がどの様な機序で誘起されるかは不明である。
卵巣摘出モデルラットにおける感覚回路の変化
つぎに,両側卵巣摘出モデルラットにおける痛覚過敏の発生機序について,最近,筆者の研究室で得た知見を紹介したい。人間の女性で閉経後の痛覚閾値がどの様に変化したかを調べるのは,多くの要素が関与してくるため容易ではない。しかし,モデルラットでは,尻尾を熱湯につけ尻尾をはねるまでの潜時をみる尻尾引っ込み試験(tail
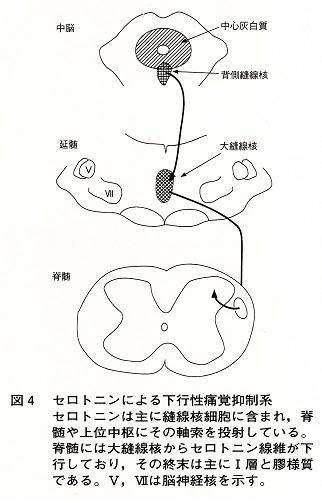
withdrawal test)を行ってみると明らかな痛覚過敏が起こってくる。この痛覚過敏には,生体内痛覚抑制系の一つであるセロトニンの関与が考えられた。このセロトニンを含む下行性痛覚抑制系は,脳幹に存在する縫線核,特に大縫線核に起始し,脊髄後角に終末し痛みを選択的に抑制することが知られている(図4)3)。
卵巣摘出ラットでは,脊髄内でのセロトニン結合部位が減少すること,また,セロトニンを枯渇すると同じ様な痛覚過敏が起こる事実などで支持されてきた。しかし,セロトニンが脊髄後角でどの様な作用を示すか,また,卵巣摘出でどの様な変化が起こるかは不明であった。そこで筆者の研究室では,ラット脊髄のスライスに後根を付した標本を用いセロトニンの作用機序を調べ,それが卵巣摘出でどの様に変化するかを明らかにしてきた。その結果,正常ラットの膠様質では,セロトニンはAδとC線維終末に存在するセロトニン受容体を活性化し,シナプス前性に伝達物質の放出を抑え痛みを抑制していた。ところが,卵巣摘出ラットの膠様質では,Aδ線維終末のセロトニン受容体は変わらず,C線維終末に存在するセロトニン受容体数が減少していた(図5)。
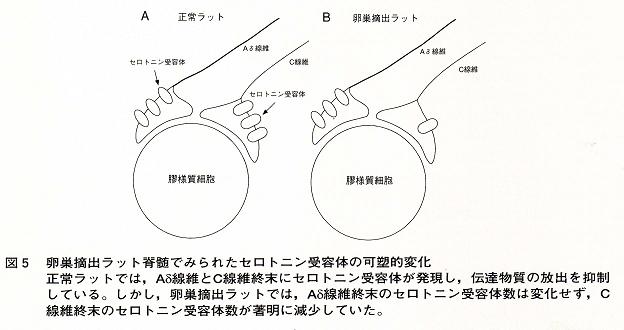
C線維が痛みの情報伝達に重要な役割を果たしていることを考えれば,C線維からの伝達物質放出が抑制されなくなること,即ち,セロトニンを介する下行性痛覚抑制系が働かなくなることを示す結果である。このことは,セロトニン受容体の発現が女性ホルモンによって一部コントロールされていることを示唆する。筆者らは,このセロトニン受容体の発現にどの様なホルモンが,どこでどの様に作用しているかを,今後明らかにしていきたい。
以上述べてきた様に,末梢神経損傷に伴なって起こる脊髄後角の可塑的変化には多くの要因が関与している。この他にも,痛み刺激によってオピエイト合成に関連するmRNAの増加も報告されており,末梢神経の損傷の違いにより多様な変化が惹起されると推測される。その変化の違いによって種々の痛みが発生しているのであろう。これら神経因性疼痛の発生機序の研究は,今後もモデル動物を用いた解析が主になると思われるが,ただ,本稿で概説してきた感覚回路網の変化をモデル動物で観察された行動学的変化の発生機序と単純に関連づけることには注意を要する。そのためには,可塑的変化と行動学的変化との時間経過やその程度の関連を綿密にみていく必要がある。
終わりに
中枢神経,特に脊髄での痛覚伝達機構の解明は,解剖・免疫組織学的手法によって大きく進展してきたが,その機能の面における解析は,invitro標本の開発が困難であったため,痛み情報がどの様な修飾・統合を受けているかは長い間不明であった。しかし,最近のslice
patch clamp法の開発によって,脊髄後角細胞から記録が容易に行える様になり,ここ5年の間に,世界の多くの研究者がその機能の解明に取り組む様になってきている。それは,米国神経科学学会や国際生理学会などで,痛覚機能に関する発表の著明な増加にも現れている。
痛みからの解放が人の根元的な願望であることは明らかであり,それを追求する方法が開発されれば,痛みは,若い人々の研究対象として非常に興味のある分野と考えられる。また,分子生物学的手法も取り入れた,学際的な取り組みが既に始まっており,今後の研究は,生理的状態における痛覚伝達機序から,病的状態における痛覚伝達異常の解明へと大きく焦点が移ってくるものと思われる。
参考文献
1 ) Woolf, CJ, Shortland, P and Coggeshall, RE : Peripheral nerve injury triggers central
sprouting of myelinated afferents. Nature 355 : 75 - 77, 1992.
2 ) Rexed, B : The cytoarchitectonic organization of the spinal cord in the cat. Journal of
Comparative Neurology 96 : 415 - 495, 1952.
3 ) Yoshimura. M : Slow synaptic transmission in the spinal dorsal horn. In Progress in Brain
Research. pp443 - 462, (eds) T Kumazawa, L Kruger and K Mizumura. Elsevier. Amsterdam,
1996.
4 ) Bliss, TVP and Lomo, T : Long-1asting potentiation of synaptic transmission in the dentate
area of the anaesthetized rabbit following stimulation of the perforant path. Journal of
Physiology (London) 232 : 331 - 356, 1973.
5 ) Randic. M. Jiang, MC and Cerne. R : Long-term potentiation and long-term depression of
primary afferent neurotransmission in the rat spinal cord. Journal of Neuroscinece 13 (2) : 5228 - 5241, 1993.
6 ) Ito, M, Sakurai, M and Tongroach, P : Climing fibre induced depression of both mossy fibre
responsiveness and glutamate sensitivity of cerebellar Purkinje cells. Journal of Physiology
(London) 324 : 113- 134, 1982.
7 ) Bennett, DL, French. J, Priestley, JV and McMahon, SB : NGF but not NT - 30r BDNF prevents the A fiber sprouting into lamina 11 of the spinal cord that occurs following axotomy. Molecular Cell Neuroscience 8 : 211 - 220, 1996.
8 ) Colamarino, SA and Tessier - Lavigne, M : The role of the floor plate in axon guidance. Annual Review of Neuroscience 18 : 497- 529, 1995.
9 ) Takahashi, T. Momiyama, A, Hirai, K, Hishinuma, F and Akagi, H : Functional
correlation of fetal and adult forms of glycine receptors with developmental changes in inhibitory
synaptic receptor channels. Neuron 9 : 1155-1161, 1992.
10) Fitzgerald, M, Butcher, T and Shortland, P : Developmental changes in the laminar termination of A fiber cutaneous sensory afferents in the rat spinal cord dorsal horn. Journal of Comparative Neurology 348 : 225 - 233, 1994.
11) Park, J - S, Nakatsuka, T, Nagata, K, Higashi, H and Yoshimura, M : Reorganization of the
primary afferent termination in the rat spinal dorsal horn during post - natal development.
Developmental Brain Research 113 : 29 - 36, 1999.
12) Nakatsuka, T, Park, J - S, Kumamoto, E, Tamaki, T and Yoshimura. M : Plastic changes
in sensory inputs to rat substantia gelatinosa neurons following peripheral inflammation. Pain,
1999 (in press)
13) Ruda, MA, Bennett, GJ and Dubner, R : Neurochemistry and neural circuitry in the dorsal
horn. In Progress in Brain Research. Vol. 66. pp 219-268, (eds) PC Emson, MN Rossor and M
Toryama. Elsevier, Amsterdam, 1986.