|
座談会・最新のRA(リウマチ)薬物療法
Arthritis(アルスライティス/運動器疾患と炎症) 2005 Vol.3 No.2 山本 本日は最新の関節リウマチ(RA)の薬物療法について、お話を伺いたいと思います。RA診療においては、関節炎のなかからいかに早期のRAを見分けるかが重要な問題になると思います。早期のRAの診断法について、三森先生、お話しいただけますか。 早期RAの診断方法 三森 実際の診断では,いつRAの治療を始めるべきかが問題になりますので、あくまでACR(アメリカリウマチ学会)の基準(表1)に従った診察所見を治療方針の指標にしています。典型的でない例、例えば間質性肺炎で発症したり、関節炎よりも発熱と炎症反応が目立つケースではMRIを撮ることがあります。このようななかに、患者さんが症状を訴えていなくても、かなり前から関節炎があったと思われる例もあります。 山本 MRIではどういう所見に注目したらよいのでしょうか。 三森 脂肪抑制で写したT1像や、ガドリニウムの早期相での取り込みなどですね。 山本 滑膜の増殖などがわかりますか。 三森 早期にガドリニウム造影で滑膜肥厚やT1像での骨びらんをみることがあります。 山本 三森先生から「診断はACRの分類基準に従う」というお話が出ました。本当に早期のRAがあるかどうかはいまだ不明確なのですが、実際に完成されたRAではACRの基準はかなりの感度・特異度を示します。ただ、発症して1年以内のRAに関していえば、なかなかACRの分類基準 竹内 血清学的な検査でいうと、ACRの項目に入っているリウマトイド因子(RF)も早期では頻度が低く、50%に満たないというのがコンセンサスですので、これを早期RAの診断に用いるのは難しく、滑膜増殖の指標になるMMP-3(マトリックスメタロプロテイナーゼー3)、それから欧州のグループから最近提唱されている抗CCP抗体が診断に用いられるようになってきました。 それに先立ち、日本では抗ガラクトース欠損1gG抗体などが使われており、RFより早期における出現率が高いといわれてきましたが、抗CCP抗体は、欧州の成績では早期で80%程度の陽性率という報告もありますので、日本で使われるようになれば非常に期待できます。 一方、MMP-3はRAに特異性が高いとされていますが、RAでなくても上がるケースもあり、確定診断には使いにくいかもしれません。 山本 ACRの診断基準を満たさなくても、これらのマーカーが陽性であれば早期のRAと診断してもよいと思いますか。 竹内 MMP-3は今お話ししたような理由で難しいと思います。しかし、抗CCP抗体はかなりRAに特異性が高く、ほかの疾患ではほとんど陽性が出ませんし、抗CCP抗体陽性の患者さんで臨床症状のない症例を追っていくと、あとでRAが発症したケースもありますので、かなり期待できると思います。 山本 報告によって違いますが,抗CCP抗体は特異度が90〜98%で、感度がRFとほぼ同じなので、すべての患者さんが陽性になるわけではないとしても、抗CCP抗体陽性である早期の関節炎の患者さんは、まず90%以上の特異度をもってRAと診断してよいと思います。 抗CCP抗体は「抗シトルリン化ペプチド抗体」の意味ですが、われわれはシトルリン化する酵素の1つであるPAD14がRAと関連していることを報告しました。こういうデータと欧州の研究者が報告している抗シトルリン化抗体の特異度を含めて、RAとシトルリン化が非常に密接に関係していることはまず間違いないだろうと考えられています。 三森先生、今話題になったもの以外に、関節炎を呈する患者さんを早期に診断するコツはありますか。とくに鑑別診断の注意点として、どんなものがありますか。 三森 頻度は低いと思いますが、多発性筋炎などでは関節炎が先行する例もありますので注意が必要です。また、全身性エリテマトーデス(SLE)はRAと区別が容易といわれていますが、一部難しいところがあると思います。関節炎のみが先行するSLEがありますから、これを早期RAとみなして抗リウマチ薬を始め、そのうち白血球減少がみられたときにも薬の副作用かもしれないとまた誤認する、などということはあり得ないことではないのです。RAの30〜40%で抗核抗体陽性 抗CCP抗体については、RFに比べて早期の陽性率が高い可能性があると思いますが、経時的変化をレトロスペクティブに調べた当科のデータによると、CRP(C-reactiveprotein:C反応性蛋白)とかなり相関しますので、炎症反応がない段階で予測できるかどうかはまだわからないところです。 山本 そのほか、リンパ腫など注意しなければいけない疾患がありますが、最近出ました日本のガイドラインでも、ACRのガイドラインでも、「早期の原因がわからない関節炎は、一度リウマチ専門医にコンサルトして診断を仰ぎ、その後一般の医師が経過観察するように」と打ち出していますので、参考にしていただければと思います。 さて、RAと診断を下したあとの治療方法ですが、最近、以前とは考え方が変わってきているようです。竹内先生、この辺りをご説明いただけますか。
RAの治療体系の考え方 竹内 従来はピラミッド治療体系で、まず基礎療法があり、その上に薬物療法がきて患者さんの痛みをコントロールするために非ステロイド性抗炎症薬(NSAIDs)が使われてきました。そしてNSAIDsの効果が十分出ないときに抗リウマチ薬(DMARDs)を使い、さらにその上に免疫抑制薬、あるいはステロイド薬というように、ピラミッドの頂点に向かって少しずつ治療を強めていくやり方でした。NSAIDsは痛みを止めるうえでは有効ですが、決して関節破壊は食い止めない。それから炎症反応、CRPを低下させないことがわかり、それでは対症療法に過ぎないのではという疑問から、RAの根本的な炎症を止めるDMARDsをより早く積極的に使おうという流れに最近変わってきました。 日本では1995年から、故柏崎禎夫先生(元束京女子医科大学教授)たちが厚生労働省の班で新しい治療指針を提唱されて、診断時にNSAIDsで痛みをコントロールしつつ、なるべく早くDMARDsを使う治療体系をつくられましたので、日本でもRAと診断された場合には、NSAIDsと同時にDMARDsを使うのが最近の流れになってきたのではないでしょうか。 山本 ACRのガイドラインでも、診断してから3ヵ月以内にDMARDsを使うことが記されていますね。 竹内 そうですね。むしろACRのガイドラインは、DMARDsを使うことは書いてありますが、NSAIDsやステロイド薬はあくまでも「consider」、医師が適宜投薬を決定するという位置づけになっています。 山本 第一義的に使う薬としてDMARDsが入ってきたということですね。 今、竹内先生がいわれたように、以前は第一選択薬であったNSAIDsが、対症療法に過ぎないことから補助的な治療薬になりつつあるということですが、NSAIDsは意外に副作用が多く、とくに消化管の潰瘍が多発するという考え方を踏まえての変化だと思います。COX-2阻害薬を含めて三森先生、いかがお考えですか。
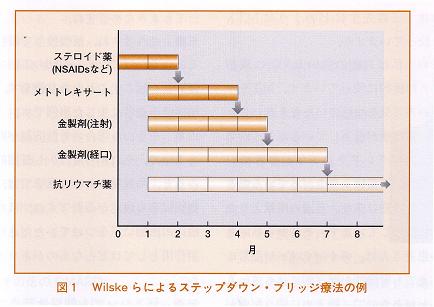
1.NSAIDs・ステロイド薬 三森 COX-2選択性の高い薬は胃腸障害が少ないのは確実なことだと思います。私たちはしばしばエトドラクやメロキシカムを使いますが、効果がやや弱い印象です。私の場合、RAの治療にNSAIDsを使うことはあまりなく、RAかどうかがまだわからない早期の段階で使用することが多いです。自然寛解するRAもある、あるいはRAでないかもしれない、そういう段階での選択として使っています。 RAであることがわかった時点で、痛みが強い場合はステロイド薬を優先的に使っております。 山本 自然寛解するRAの取り扱いについてはなかなかコンセンサスがなく、本当にRAだった場合は自然寛解しないだろうという考え方も最近出てきていますが、本当にRAだったかどうかという場合を含めて,ステロイド薬はどのくらい使っておられますか。 三森 プレドニゾロンを10mg以内、多くは5mgです。とくにメトトレキサート(MTX)などの効果が出るまでのあいだ使う場合が多いです。 山本 「ステップダウン・ブリッジ療法」(図1)といわれているものですね。1995年にキルバン(Kirwan
JR: N Engl J Med333:142-146.1995)たちが7.5mgのステロイド薬を発症2年以内の患者さんに使い、かなり骨破壌を抑えることができたけれども、使用をやめるとまた骨破壊が進展した
竹内 原則としてステロイド薬は使わない方針です。ステロイド薬を使うと患者さんの症状も、炎症反応も良くなって,DMARDsが効いているのかどうか効果判定がしにくくなるので使わないのですが、米国では積極的に使う医師が圧倒的に多いようですね。これは個人の考え方によるのではないかという気がします。 効果判定が難しくなるという理由に加えて、MTXを投与してその効果が不十分な場合、効果判定までの期間がステロイド薬を服用していると、より長くなってしまうということがあります。 それからステロイド薬は投与2年を超えると患者さんのQOLを低下させてしまうというエビデンスが沢山出ています。2年以上は便わないのがコンセンサスではないかと思います。 三森 例えぼ60mgのプレドニゾロンを使って1週間ごとに下げていく
COBRA-study〔Combinatietherapie Bij Rheumatoide Arthritis (Lancet 1999
Arthritis Rheum 2002に続報)〕 竹内 例えば2年間は、骨破壊はステロイド薬を使わない患者さんに比べると抑制します。ただ、ゼロではないということと、ステロイド薬をステップダウンして投与しなくなったあとは、炎症も骨破壊も進行は前と同じになります。 山本 なかなか難しい問題で、短期的にはステロイド薬の有効性は誰もが認めるのですが、大量に使ってもRAを寛解に導くことはできない、長期的な場合にはなかなか中止することができないことから、ステロイド薬は慎重に使うべきですが、少量投与の有効性についてはまだはっきりしていないです。 ただ、少量といっても欧米の基準の7.5mgよりも少量、5mg以下の3mg、2mgを上手に使っている専門家が結構いると思われます。 次に「RAと診断したらまず投与」という考えに最近変わってきたDMARDsですが、沢山の薬剤があるなかで注目すべきはMTXだと思います。MTXの実際の使用について、メカニズムも含めて、竹内先生お話しいただけますか。 2.DMARDs〜MTXを中心に〜 竹内 MTXは最初は乾癬の治療薬として使われていましたが、関節炎を合併した乾癬性関節炎に偶然使ったらよく効いたという臨床経験から、これはRAに効くのではないかと考えられたのが最初のようです。 MTXは代謝拮抗薬で、葉酸代謝をブロックしてピリミジンを取り込めなくして、細胞の分裂活性化を防いで滑膜増殖や免疫系を抑制するのでRAに効くのだといわれています。 非常に面自いことに、1週間のうち、ある一定期間だけ飲む少量パルス投与が世界の標準薬に近いくらい広く使われており、DMARDsの第一選択薬としても使われています。 山本 わが国ではほかのDMARDsに低抗性の患者さんが適応で、なおかつ投与量も8mgと決められています。それについては竹内先生、どうお考えですか。 竹内 本来は適応のある患者さんには積極的に早期から便うべきだと考えますが、薬の適応、使い方は守らなければいけないと思います。 それから今ご指摘になりました最高用量が週8mgというのは、世界的にみると驚くほど低い用量ですが、日本で行われた治験では、2mg、6mg、9mgで比べて、効果は6mgと9mgで差がなかった。ただし副作用は9mg群で有意差があり、6mgより肝機能障害が高かった。また9mg群でのみ血球減少症がみられたので、最高用量が8mgになったと聞いています。 ですから私どもは8mgを超えて使うケースもありますが、やはり用法・用量は添付文書に従うほうがいいと思います。 山本 三森先生はどのようにMTXを使っていますか。 三森 私は炎症の強いRAには最初から積極的に使っています。MTXの使い方で気をつけていただきたいことは、腎機能が低下しているかどうかです。血清クレアチニン(Cr)をみていただき、正常値より上がっている患者さんには避けるか、普通の用量よりさらに減らしています。それから高齢者の患者さんは、みかけのCrが正常にみえても腎機能が潜在的に落ちていることがあるので、控えめに使う配慮が必要だと思います。 山本 高齢の患者さんは脱水状態から簡単にMTXの血中濃度が上がってしまうためですね。 三森 そうですね。反復投与で蓄積するというわけでなく、最初の1回で骨髄抑制を起こすこともあり得ます。腎機能低下患者に生じた事例です。 山本 そういう場合の骨髄抑制が問題の1つで、それからもう少し長期的にみると、用量反応という意味では、肝機能障害も注意が必要ですね。ほかに臨床の医師に気をつけていただきたい 三森 何といっても間質性肺炎ですね。これは症状が明確で、咳と発熱と息苦しさが続くものですが、これをあまり強調すると風邪の症状でも心配される患者さんが出てきますが、持続性で熱と咳という組み合わせがあったときは、すぐ服薬をやめて医師に知らせるように伝えておくことが必要だと思います。 山本 米国では7.5mgから始めてすみやかに15mgまで増量し、効かないときには25mgまで、というのが標準的な使い方なのに対して、竹内先生がいわれたようにわが国では8mgという上限があって、実際に6mg、8mgという少量でよく効いている患者さんもいる。その評価をどうするかは難しいところですが、一般の臨床医はとりあえず8mgを守ってもらい、RAの専門医のなかには、それよりも多く投与する場合もあることを知っておいていただきたいと思います。 それ以外のDMARDsでは昨年から話題になりましたレフルノミドについて、問題点も含めて三森先生、お話をうかがえますか。 3.その他のDMARDs 三森 レフルノミド(ピリミジン拮抗薬)はMTXと効果も非常に似ており、同等、時にMTXで効かない例に著効することもあります。 MTX肺炎の既往があるため、あるいは間質性肺炎があるために、MTXが使いにくいという患者さんがいます。一方、レフルノミドは欧米での使用経験から間質性肺炎の副作用がないといわれていましたので、私たちもかなり期待していました。しかし日本の市販後調査では5,000例に使われて1%と非常に高い頻度で間質性肺炎が起きました。しかも問題はその40%が死亡したという事実です。その組織型がほとんどびまん性肺胞傷害(diffuse alveolar damage;DAD)でした。 山本 急性の間質性肺炎ですね。 三森 そうです。治療抵抗性のものです。これは「MTX肺炎」とまったく違いますから非常に危 山本 実際に間質性肺炎像を呈していた患者さんをよく調べてみると、カリニ肺炎の可能性もあるという指摘もありますが、それでもやはり急性の間質性肺炎が大きな割合を占めているということですね。 三森 そうですね。病歴調査の結果、レフルノミド使用中に起きた死亡例の半数は感染症と認定されています。しかし、これも薬剤による免疫抑制の結果だとすれば、重大な問題です。 山本 欧米ではかなり多くの患者さんに使われていても間質性肺炎の頻度はそれほど高くなかったため、民族差も含め問題になっています。素因を含めて慎重投与が必要ですが、効く患者さんがいるのですから、正しい判断で便っていく必要があると思います。 それから移植の領域で使われているタクロリムスが認可されましたが、このタクロリムスについて竹内先生,ご説明をお願いします。 竹内 この薬剤は移植の拒絶反応を抑える、T細胞に作用する薬剤です。その作用点はT細胞のシグナル伝達にかかわるカルシニューリンという分子の働きを抑えて作用する薬剤です。 したがって、RAの関節炎で中心的な働きをしていると考えられるT細胞を抑える効果があると期待されましたし、日本でも治験が行われて、臨床的にはMTXほどの切れ味は感じられないのですが、それでもACR20という指標を用いると40〜50%まで効くということで期待されている薬剤で 最大の特徴は、作用点がT細胞のカルシニューリンにあるため、何もかも抑えてしまうわけではないということで,MTXのもっている副作用のプロフィールとは違うところです。例えば肝障害などは非常に少ない。それから膠原病の間質性肺炎などには、逆に治療薬として使うことがよくある薬ですので,副作用としての間質性肺炎は起こさないのではないかと期待できます。 おもに安全面に対して、これまで私たちが手にしたことのないDMARDsになり得る期待があります。 山本 現在タクロリムスは間質性肺炎をもっている患者さんに使える薬ではないかと期待されているのですね。 竹内 ただし、レフルノミドの教訓がありますので慎重に考えなければいけないと思いますが。 山本 タクロリムスは実際に間質性肺炎をもっている多発性筋炎などの患者さんには、適応外であっても積極的に使う場合もあります。 では、タクロリムスで気をつけなければいけない副作用としてどんなものがあるでしょうか。 竹内 長期に使っていて起こる問題点としては、高血圧、腎機能障害、糖尿病の悪化など、今までのDMARDsにない副作用がありますので、注意しなければいけないと思います。 山本 膠原病ではもうすでに使っているリウマチ専門医が多いわけですが、RAで使えるようになるとまた新たな展開があると思います。 さて従来の薬に属するNSAIDs、ステロイド薬、DMARDsのお話を伺いましたが、21世紀になて、RAの治療くらい目覚ましい変化がみられる領域はほかにないといわれているくらい、新しい生物学的製剤が入ってきています。 まず「生物学的製剤」というのはどんなものかということについて、竹内先生お願いします。 4.生物学的製剤 竹内 まず生物学的製剤の定義ですが、言葉が非常に難しくてなじみにくいのですが、「生物から産生される物質を薬剤として利用した製剤」です。 おもに蛋白質で、標的となる分子の働きを抑えようという目的で人工的に設計された蛋白質製剤といえます。現在、この生物学的製剤として使われている薬剤には、大きく分けて「抗体製剤」と「受容体拮抗薬」の2つのタイプがあります。一番ポピュラーなのが抗体製剤で、RAの炎症で最も悪影響を及ぼしているものに抗体をつくり、その分子の働きを抑えようというものです。もう1つは、ある標的となる分子が作用するときには受容体を介して作用しますので、その受容体に非常に似た構造物をつくると、その標的分子の働きが抑えられるという受容体拮抗薬という形があります。 山本 標的となる分子にはどんなものがありますか。 竹内 一番臨床応用が盛んに行われたのが炎症性サイトカインと呼ばれるおもにRAの炎症のもとといわれた物質です。そのなかの3種類が標的になり、腫瘍壊死因子(TNF)とインターロイキンの1(IL-1),そして6(IL-6)の3種類が格好の標的になってきました。 山本 日本では欧米に比べると遅いのですが、TNFを標的としたモノクローナル抗体がすでに認可され、さらに今年になり中和作用があるTNF受容体の融合蛋白が認可されていますが、こうした製剤を竹内先生、実際にはどういう患者さんに使われますか。 竹内 キメラ型のTNF-α(腫瘍壊死因子)の抗体、インフリキシマブといいますが、これはキメラ型であるために免疫抑制薬、とくにMTXと一緒に使わないといけません。患者さんに繰り返し打つうちに中和抗体ができてしまうので、この薬剤はMTXが効果がない人にMTXを飲みながら点滴をするという使い方になります。患者さんの適応としては、MTXを使っても効果がない活動性のRAです。 一方、受容体拮抗薬であるエタネルセプトという薬剤がありますが、このTNF受容体とヒトlgG-Fcとの融合蛋白は、本来!00%ヒトの蛋白構造をもっているため、単独で投与しても中和抗体ができない。それでMTXが使えない患者さんにも単独で使えるという特徴があります。
山本 三森先生はどのような患者さんに生物学的製剤を使っていらっしゃいますか。 三森 やはり薬物療法でコントロールできない重症の患者さんになります。それはおもに経済的な理由からそう考えています。 今いわれたような中和抗体を防ぐということ以外に、生物学的製剤はどの製剤もMTXと併用することが望ましいのであろうと思います。 山本 生物学的製剤、とくにTNF拮抗薬は、患者さんが本当に効いたと実感できるACR50を達 竹内 臨床効果を良くするカはご指摘になったとおりで、MTXと比べて大差がないのです。もちろんコンビネーションで使えば一番いいのですが、MTXと生物学的製剤を比べてみると、最大の差は関節破壊抑制効果が圧倒的に違います。とくにTNF拮抗薬のインフリキシマブ、エタネルセプト 山本 RAの薬物療法の大きな目標は、関節破壌の抑制あるいは改善ですが、それを達成し得る薬として注目されているということですね。 この点に立脚して、欧米での最近の生物学的製剤の使用はどのようになっていますか。 竹内 日本でもそうですが、欧米でも最初は平均罹病期間10年の、しかもMTXが効かない患者さんに生物学的製剤を使っていました。それでは関節破壊が一番進行する2年目、3年目が過ぎてしまっており、すでに関節が壊れてしまっているので、使われる時期が徐々に早くなってきています。 例えば、エタネルセプトとMTXを比べたTEMPO研究によると、平均罹病期間約6.6年で使われており、さらにはインフリキシマブのASPIRE試験は平均罹病期間3年以内、大体1年で、非常に早期から積極的に使われ、その結果、「生物学的製剤+MTX」の併用効果が最も高い臨床効果と関節破壊抑制効果が得られることがわかりました。欧米では、予後不良のRAにMTXと生物学的製剤が早い段階で併用されることがあります。 山本 欧米のRA専門のクリニックによっては3〜4割、または半分以上の患者さんがTNF抑制療法もしくは生物学的製剤を使っているとのことです。もちろん良い面はありますが、一方で生物学 三森 やはり肉芽腫性の感染症,代表的なのが結核ですが、その頻度が明らかに増えます。とくにもともと感染していた人の再燃が大きな問題になっていて、一番気をつけなければいけないことです。 山本 特徴としては結核のどんな症状が出ますか。 三森 とくに特徴はないと思いますが、肺外結核に注意しなければいけないと思います。肺外結核は診断しにくく、私たちもほかの施設でインフリキシマブを使われていた患者さんが発熱で来院して、腸結核と診断して治療した例があります。これも注意すべきだと思います。 もう1つがMAC (Mycobacterium avium complex)をどのように考えるかです。これはまだ決まったガイドラインがないと思いますが、問題はこういうことです。まず、RAの人たちは数%に慢性気管支炎症状があります。自験集計によれば約300人のRA中7%が慢性気管支炎の定義を満たしました。RAそのもので起きると考えられますが、その半数以上の人に気管支拡張や、副鼻腔炎を伴ったタイプがみられます。菌を培養するとガフキー陰性でもMACが生えてくることを時々経験しますので、それに対してTNFを抑える治療をすべきかどうかが非常に問題になると思います。慢性気管支炎ないし気管支拡張症がある例にもやめるべきだということになると、かなり使用が制限されてきます。 山本 今、三森先生がいわれた細気管支炎(bronchiolitis)の患者さんから検出されるMACなどの非定型抗酸菌が,必ずしも病態を起こしているかどうかは別問題ではないかと思うのですが、いかがでしょうか。 三森 「使用してもかまわない」という考え方もあります。ただ、確率は低いとはいえそれが活動性を示したとき治療法がない場合もあるのですね。ある意味で結核よりも扱いにくくなることがあり得ますね。 山本 結核ほどラッシュにはきませんが、治療低抗性でジワジワと再燃して,病原性をもってくる可能性があるということですね。なかなか難しい問題です。MACについては、竹内先生何かござ 竹内 これは世界的にも報告されていますが、そのバックグラウンドのMACの発症率がわからないのです。TNF阻害療法によって本当にMACの発症頻度が高まるのかというデータはないで 山本 欧米での非定型抗酸菌症は、むしろ、M.kansasiiのほうが多く、わが国はMACが多いので、これからの問題になってくるかもしれないですね。 これを踏まえて、竹内先生が班長をされている研究班を含め、厚生労働省の研究班3班の先生方が抗TNFの生物学的製剤を使うにあたってのガイドラインをつくられましたが、竹内先生、簡単な骨子をご説明いただけますか。
竹内 宮坂(東京医科歯科大学)、竹内、江口(長崎大学)の3班でつくったガイドラインなのですが、例えば欧米に比べて日本の結核の発症頻度が高いという状況を踏まえて、日本に生物学 1つは、「白血球の数は4,000/mm3以上、リンパ球の数は1,000/mm3以上、そしてβ-D-グルカン陰性」という3つの条件と、それからレミケード、インフリキシマブで禁忌になっている結核の既往の患者さん、あるいは胸部レントゲンで結核を疑わせるような異常のある患者さん、ツベルクリン反応が陽性の患者さんについては当初正確な規定がなかったのですが、今では紅斑20mm以上、あるいは硬結のある例ということになっています。 三森先生がいわれたように,最も注意しなければいけないのは結核をはじめとした呼吸器感染症、それから日本で多いことがわかったカリニ肺炎、それから肺炎ですね。とくに肺炎が最も多かったので、この3つをポイントとして挙げて、それをコントロールすることを意識してガイドラインをつくりました。
これからのRA治療 山本 診断から最近の生物学的製剤までお話しいただきました。最後にまだまだRA治療は完壁ではなく、将来的にはより良い治療が望まれると思います。そこでどんな治療法が近未来に望まれるかについて、具体的に竹内先生いかがでしょうか。 竹内 今までのエビデンスというのは、ある薬剤を患者さんの集団に与えて、効いた患者さんがより多くいる薬剤が勝ち、という薬剤判定をしていましたが、これでは必ずしも個々の患者さんには通用しません。そこで今後はテーラーメイド医療、個々の患者さんに即した治療体系になっていくと思います。 そのために、この薬はどういう患者さんによいか、あらかじめ予測ができて、またこの患者さんは将来的には悪化するRA、あるいはそれほど進まないRAなどがわかってくると、個々の患者さんに即した最適の治療が展開できると思います。そういうテーラーメイド医療が、今後の方向性の1つになるかと思います。 山本 テーラーメイド医療を扱うには、何を測って個人の違いをみることになりますか。 竹内 これは非常に難しい問題で、山本先生たちがやられているように、その個人の体質から切り込んでいくのが最も確実な情報が得られると思います。SNPsを利用する方法や、遺伝子情報を利用する方法ですね。
山本 竹内先生が今やられているような遺伝子発現についてはどうでしょうか。 竹内 遺伝子発現も今非常にいいデータが出揃ってきているのですが、体質ほど確固たるデータではないです。発現解析していきますと、これまで私たちが考えてもみなかったものが出てき 山本 ゲノムのDNA、それからmRNAを測っていくのは、1つの大きなテーラーメイド医療の指標になると思いますね。 三森先生、ほかにどんな治療が将来的に考えられるでしょうか。 三森 今までのお話以外のことを挙げるとすれば、破骨細胞を抑えるということですね。炎症を抑えるのは重要な課題ですが、何といっても骨破壊を抑えることが最終目標です。炎症と切り離してコントロールできそうな可能性もあるといわれていますし、身近な例ではビスフォスフォネートを使っても臨床効果が得られる可能性があるわけです。もちろん、破骨細胞抑制のためにはほかの経路を抑える治療法の開発も十分考えられます。 山本 炎症に続いて破骨細胞が活性化されるという経路は今でも重視されていますが、それ以外に、炎症があまりなくても骨破壊が進む例があるため、破骨細胞をターゲットとした治療法が 私たちは、少し遠い将来になるかもしれませんが、より選択性、特異性のある治療を模索しています。可能かどうかわかりませんが、RAに特異的な免疫応答を検出してそれを抑えていくようなもの、または関節に特異的な免疫抑制療法が可能ではないかと考えています。動物のモデルでは、そういう治療法が可能であることは示されていますし、私たちもやっていますが、実際の患者さんに使えるかどうかについて今後検討していきたいと思います。これも可能性の1つになるかもしれません。 本日は診断から最近の生物学的製剤、それから将来の方向までRAの薬物療法について幅広くお話をしていただきました。一般の臨床医の先生方のお役に立てればと思います。ありがとうございました。 |
|||||||||||||||||